Medical
医療

IR Information
IR情報
FTSE FAHMS FGESA AGAF, MD FRACP
フリンダース大学 マシュー・フリンダース名誉教授

1969年にメルボルン大学でMB、BSを卒業。1978年から1980年にかけてワシントン大学セントルイス校で学び、1981年に研究論文で医学博士号を取得。メルボルン大学で教鞭を執った後、1997年に南オーストラリア州フリンダース大学の消化器病学の教授に任命。2011年には、フリンダース大学のグローバル胃腸衛生学教授に任命され、マシュー・フリンダース名誉教授の称号を授与される。2つのアカデミーと3つの専門機関のフェロー。
1998年、世界内視鏡機関(WEO)の大腸がん検診委員会の創設メンバー。2005年から2013年にかけてこの委員会の委員長を務め、現在もこの分野の主要な国際出版物と医療政
策のリーダーとして活躍。委員会の最初の20年間で、集団ベースの組織的大腸がん検診を実施している国の数は、わずか2カ国から40カ国以上に増加し、そのほとんどが免疫法便潜血検査(FIT)を用いて検診を実施。
大腸がんのスクリーニングとバイオマーカー、スクリーニングの方針とその実施に関する国際的に認められた専門家。国際的な同僚との初期の研究により、FITが多くの国で大腸がんスクリーニングを確立する上で重要な役割を果たす。グローバルで400人以上の同僚とともに、500近くの科学および医学論文を発表。
主な受賞歴: 2017年:オーストラリア博物館ユーレカ賞(医学研究におけるイノベーション部門)。 2014年:オーストラリア勲章(AM)。2013年:南オーストラリア州サイエンティスト・オブ・ザ・イヤー。 2009年:オーストラリア消化器病学会の著名な研究賞。
大腸がんはがん関連死の重要な原因であり、主要な健康問題だ。 世界銀行による健康負担の上位10疾病にランクインしている[A]。 大腸がんの発生率には大きな地理的ばらつきがあり [B]、 開発途上国よりも先進国で高い。罹患率は豊かさの増大とともに増加している[C]。2040年には、現在の185万人から2040年には309.3万人に増加すると予測されてる[D]。
大腸がんは、最も予防可能ながんの1つであるという専門家のコンセンサス見解があるにもかかわらず、この病気の負担は依然として課題となっている[E]。 50年前、WHOは、科学的根拠と実行可能性があることを条件に、スクリーニングに対する公衆衛生的アプローチの基準を策定した[F]。30年前、決定的な科学的根拠として、便潜血化学検査(gFOBT)が、腫瘍性病変の早期発見を通じて死亡率を低下させることが証明された[G]。
大腸がんの早期診断が死亡率および罹患率に大きな影響を与えるという根拠により、現在、スクリーニングが効果的で実行可能な手段であることが示されている。現在、多くの国では、大腸がんスクリーニングに便潜血検査(FOBT)をgFOBTまたはより新しい免疫化学法便潜血検査(FIT)のいずれかの形で使用している。2018年には、年齢標準化された大腸がん罹患率(ASR、0-85歳)が10万人当たり30人以上である30カ国のうち、2カ国を除いてスクリーニングが本格的に実施されており、罹患率が10万人当たり25人以上の国では、さらに6カ国がパイロット研究を実施している。
研究によると、FITは早期がんまたは前がん腺腫の発見と切除を通じて、大腸がんの死亡率と罹患率を低下させることが示されている[H]。 高感度FITは進行性前駆病変の検出にも有用であり、除去することで大腸がんの罹患率が低下することが知られている。
定量的FITが開発されたことで、結腸直腸腫瘍の検出が改善され、FITは今や世界中で使用されている主要な便潜血スクリーニング技術となった[G]。 スクリーニング集団では、FITの感度は結腸直腸がん[I]で74〜90.5%、進行性腺腫で25〜56%である。
FITは様々な点で化学法便潜血検査より優れている。例えば、参加率の向上(これは、便サンプルが一つになったことと収集が簡易になったことに起因する)、自動分析装置による客観的で一貫した測定、がんおよび腺腫に対する感度の向上、薬や食事の影響を受けない、大腸内視鏡検査性能と検査キャパシティに合わせた客観的で調整可能なエンドポイントなどだ[J]。FITは最終的にgFOBTに取って代わり、大腸がんスクリーニングの状況を一変させた[G]。
便中ヘモグロビン(Hb)濃度の定量は、スクリーニングプログラムを管理する人々に、大腸内視鏡検査による診断検証を促す基準値(検査が陽性と報告される「カットオフ」Hb濃度)を選択する柔軟性を提供した[H]。これにより、2次検診である大腸内視鏡検査への移行が円滑になる [H]。
1980年代には、FITがgFOBTの代替となることが明らかになった。2012年までに、WEO大腸がん検診委員会のFITに関する専門家ワーキンググループは、市場に47種類のFITシステムを特定した[K]。その大半は単に定性的なカットオフを使用していた。
それ以来、大腸がんスクリーニングにおけるFITの使用方法は、いくつかの重要な問題によって左右されてきた。
第1に、人口ベースの組織的スクリーニング(PBOS)がほとんどの国で適用されている公衆衛生戦略であるという認識である[G}。これは、受診勧奨から検出までのすべてのステップで高い品質を確保し、その後の大腸がん死亡率および罹患率への影響を確保するためである。定量的FITによって、大腸内視鏡検査の限られたリソースを最も必要とする人に届けることが可能になった。
第2に、定性的なカットオフのニーズだ。定性的なカットオフは、PBOSプログラムの公衆衛生目標に必ずしも適合していない。カットオフは、検査の精度、つまり病変の検出と特異性、大腸内視鏡検査の作業負荷、そして最終的には費用対効果を決定する。プログラムは、カットオフに対してプログラムの目標[K]と一致するテストの精度とワークロードに合わせて調整できることを求めていた。定量FITによる、便中ヘモグロビンレベル(f-Hb)の高精度な定量は、プログラムに適したカットオフの選択を可能にした。
第3に、検査の自動化のニーズである。スクリーニングという大量の検査には、サンプル処理の自動化と、客観的に測定可能な検査結果を提供する自動アッセイが不可欠であった[K]。
前述した47種類のFITのうち、これらのニーズを満たすことができたのはごくわずかである。
FITを用いた大腸がんスクリーニング戦略(図を参照)では、スクリーニング経路には3つの連続した段階(分析前、分析、分析後)があり、 それぞれに独自の質的な考慮事項があることが確認されている[K]。
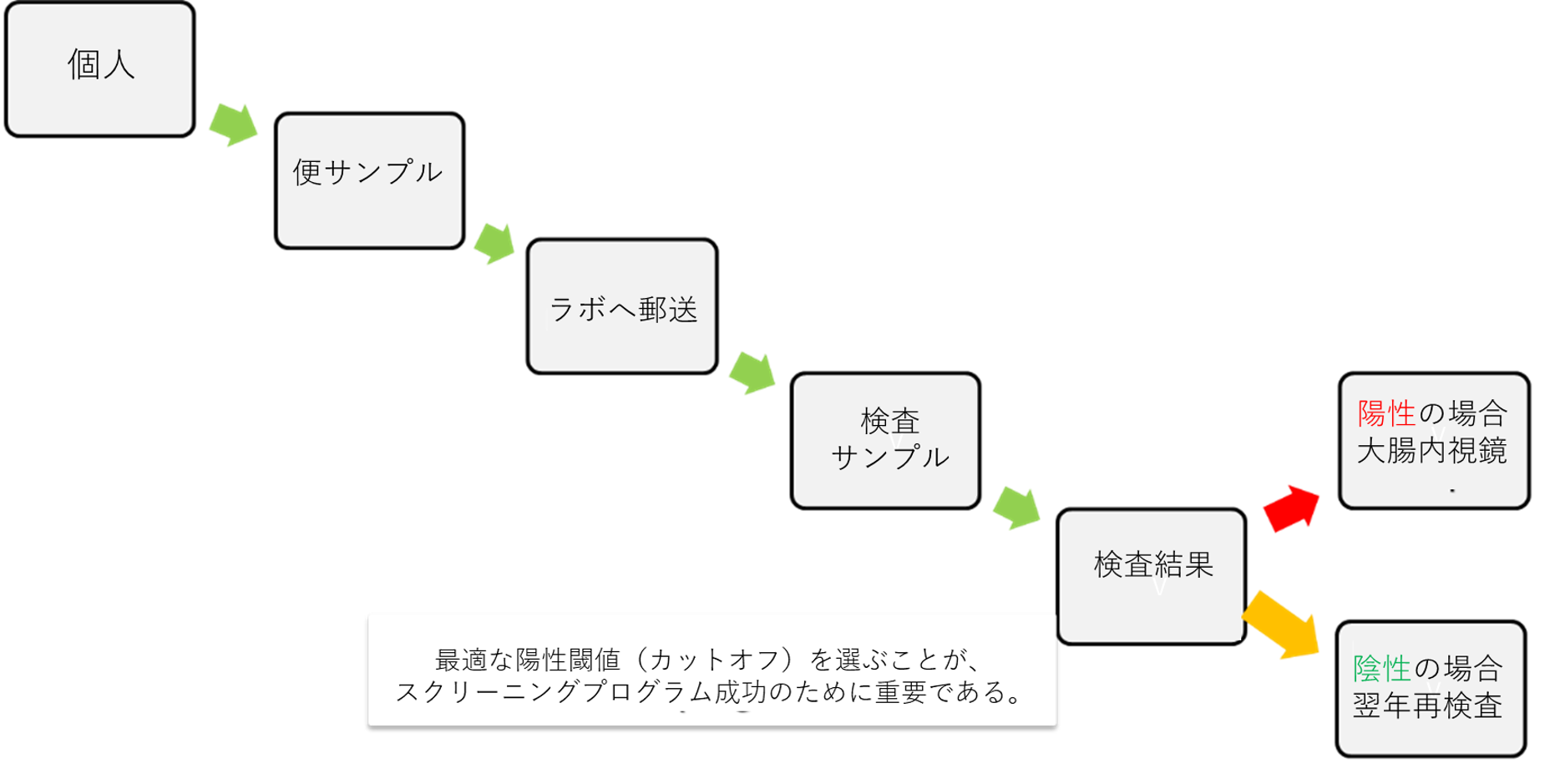
図:大腸がんスクリーニングのFIT関連のステップ。
分析前の考慮事項 [K, L]
FITに依存する分析前の考慮事項には、次のものが含まれる。
注意が必要な特定の項目は次のとおりである。
これらの特定の項目のそれぞれは、スクリーニング対象の集団に合わせてメーカーと協力してカスタマイズする必要がある場合がある。
正しくサンプリングされたサンプルを提出しなければ、病変は検出されない。サンプリングは、このフェーズの重要な品質指標だ。
分析に関する考慮事項
サンプルが検査室に到着した後、分析プロセスのすべての側面が重要だ。最終的にスクリーニングプログラムに適していると見なされるカットオフを判断するには、該当するプログラムの目標が確実に達成されるように、かなりの人数のパイロットプログラムが必要になる可能性がある。
新しい非侵襲的検査評価に関する最近のWEO EWGの推奨事項は、(詳細については[H]を参照し)次のように規定している。
「検査の分析性能特性は、国際臨床検査基準協会や米国の品質システム要件などの関連基準に従って正式に文書化する必要がある。」
FITは、その使用に必要な分析性能を満たしていることが重要だ。臨床検査試薬・機器メーカーおよび検査機関は、サンプリングから結果の報告までの様々な条件下で、正確で信頼性が高く、再現性のある結果の提供を保証するために、規制機関に準拠する必要がある [H]。
信頼できる結果は、次の条件によって異なる。
規制当局の承認には、そのようなことが実証され、試験所の継続的な認定が実施されている必要がある。
したがって、定量的FITのための検査室での理想的な分析プロセスは、以下の通りである[K]。
これらのいくつかは検査室に依存するが、メーカーはこれらの理想の達成を促進することが奨励されている。
規制の枠組みを満たすために、メーカーは、検査が該当する分析要件を満たしていることを実証する必要がある。実際に使用するには、指定された研究集団における検査の有用性(臨床精度)に関する臨床データを提供し、指定されたf-Hbカットオフに基づいて提供することも必要だ。これは、スクリーニングプロバイダーが検査を選択する際の指針となる。
分析後の考慮事項
分析後の考慮事項は、スクリーニングプログラムを実施する責任者の責任であるが、臨床検査試薬・機器メーカーにもできることがある。
1つ目は 、採便容器バッファーに通常収集される便の量とバッファーの希釈効果を補正することにより、サンプルバッファーのヘモグロビン濃度(f-Hb)を便中の濃度に変換する方法に関する情報を提供することだ。 これにより、異なるFITアッセイシステム間で測定結果を比較しやすくなる。 これにより、異なるFITアッセイシステム間で測定結果を比較しやすくなる[K]。 残念ながら、 異なるFIT試験を直接比較するための基準を提供する国際的な標準物質はない。標準物質は異なるアッセイシステムの調和のために最初に必要となるものであり、それがあれば実験室の外部品質管理プログラムも促進される。したがって、臨床検査試薬・機器メーカーは、定量結果をmcg Hb / g便として示すことを勧めたい。
2つ目は 、定量結果を報告することだ。これによりエンドユーザーがカットオフとして機能するf-Hb濃度を選択できるため、結果が陽性か陰性かを判断し、フォローアップの大腸内視鏡検査の要否を判断できる。 定量的な結果を報告する際に、規制機関によって承認されていないカットオフを使用することは、いくつかの法域で試験の適応外使用となる可能性がある。実際には、世界中で10〜120 mcg Hb / g [公開準備中のデータ]まで、幅広いカットオフが使用されており、ほとんどの管轄区域にはこの制限がない。
カットオフを選択できることで、スクリーニングプロバイダーはスクリーニングプログラムの目標に合った検査精度を選択できる。また、SARS-CoV-2のパンデミックのような状況で大腸内視鏡検査の作業負荷を効率的に管理するための最善の方法を機能させることもできる。
現在、年齢と性別に応じてカットオフを調整できることの利点があるという根拠が出てきている。年齢と性別に応じたカットオフは人口統計学的亜集団におけるf-Hbの決定要因であり、単一のf-Hbカットオフを用いた検査の有用性は、すべての亜集団で公平ではない可能性がある。
スクリーニングプログラムにカットオフをどのように設定するかは、最終的にはプログラムプロバイダーが決定し、通常、最初の実現可能性とパイロット調査によって特定される。
臨床検査試薬・機器メーカーは、FITスクリーニングにおいてプログラム目標を達成するための重要な手段を提供している。 彼らの検査は、分析の側面だけでなく、スクリーニングプログラムの分析前後の考慮事項にも関連している。
A Begg SJ, Vos T, Barker B, et al. Burden of disease and injury in Australia in the new millennium: measuring health loss from diseases, injuries and risk factors. Med J Aust 2008;188:36-40.
B Ferlay J, Ervik M, Lam F, et al. Global Cancer Observatory: Cancer Today. . Lyon, France: International Agency for Research on Cancer, 2018. https://gco.iarc.fr/today
C Ferlay J, Colombet M, F B. Cancer Incidence in Five Continents, CI5plus: IARC CancerBase No. 9 [Internet]. Lyon, France: International Agency for Research on Cancer, 2018. http://ci5.iarc.fr/CI5plus/Pages/references.aspx
D http://gco.iarc.fr/tomorrow/home
E Food, Nutrition, Physical Activity, and the Prevention of Cancer: a Global Perspective. Washington DC: World Cancer Research Fund / American Institute for Cancer Research, 2007; Lauby-Secretan B, Vilahur N, Bianchini F, et al. The IARC Perspective on Colorectal Cancer Screening. N Engl J Med 2018;378:1734-1740.
F Wilson JMG, Jungner G. Principles and practice of screening for disease. WHO Public Health Papers. Volume No. 34, 1968.
G Young GP, Rabeneck L, Winawer SJ. The Global Paradigm Shift in Screening for Colorectal Cancer. Gastroenterology. 2019;156: 843-851 e842.
H Bresalier RS et al. , Members of the World Endoscopy Colorectal Cancer Screening New Test Evaluation Expert Working Group. An efficient strategy for evaluating new non-invasive screening tests for colorectal cancer: the guiding principles. Gut, 2023; 72:1904-1918. Epub ahead of print doi:10.1136/gutjnl-2023-329701
I Lee, J.K., et al., Accuracy of Fecal Immunochemical Tests for Colorectal Cancer. Annals of Internal Medicine, 2014; 16: p. 171-181
J Young GP, Cole SR. Which fecal occult blood test is best to screen for colorectal cancer? Nat Clin Pract Gastroenterol Hepatol 2009;6:140-141.
K Benton SC et al. Faecal immunochemical tests for haemoglobin: Analytical challenges and potential solutions. Clin Chim Acta 2021;517:60
L Young GP, Symonds EL, Allison JE, Cole SR, Fraser CG, Halloran SP, Kuipers EJ, Seaman HE. Advances in Fecal Occult Blood Tests: The FIT Revolution. Digestive Diseases and Sciences. 2015; 60: 609-622.
M Symonds EL, Osborne JM, Cole SR, Bampton PA, Fraser RJL, Young GP. Factors affecting faecal immunochemical test positivity rate: effect of demographic, pathological, behavioural and environmental variables. Journal of Medical Screening, 2015 Dec;22(4):187-93.